サンプル調製ガイド
キャピラリーシーケンスサービスをご利用いただくためのサンプル調製方法についてご案内します。
DNAテンプレートの精製
サンプル中の汚染物質はサイクルシーケンス反応に悪影響を与え、低品質なデータの原因となります。
DNAテンプレートの抽出・精製には、市販の精製キットの使用を推奨します。
特にPCR産物は、必ず精製を行ってください。PCR反応後の未反応のプライマーやdNTP等が残存していると、良好な解析結果が得られません。
TE等のEDTA含有Bufferでサンプルを溶解させた場合、EDTAがサイクルシーケンス反応を阻害する恐れがあります。サンプルおよびプライマーの調製には、滅菌水の使用をお勧めします。
濃度測定について
シーケンス反応を成功させるためには、DNAテンプレートの量が適切であることが非常に重要です。
正確な定量のために、シーケンスサンプルの濃度測定法は、Qubitまたはアガロースゲル電気泳動をお勧めします。
分光光度計は、DNA以外の残存物などが含まれている場合、真の濃度と大きく乖離するケースもあるため、注意が必要です。
アガロースゲル電気泳動による濃度測定は下記のいずれかの方法で行ってください。
②(利用可能な濃度既知マーカーが無い場合)目安として、サンプル1μLのアプライで、はっきりとバンドが確認できる濃度に調製。
ご提供いただく電気泳動写真には、サンプルのアプライ量、マーカー情報(アプライ量や濃度等)を明記してください。バンドがはっきり見えているもの以外はコピーではなく現物をご提供ください。
アガロースゲル電気泳動例
プラスミドサンプル
下記はプラスミドサンプルを各1uL電気泳動した結果です。

マーカー(lane 1)の濃度 200ng/uL をもとに各サンプルの濃度を見積もると、以下の通りとなります。
| Sample A(lane 2) | 約150ng/uL |
| Sample B(lane 3) | 約400ng/uL |
| Sample C(lane 4) | 400ng/uL 以上 |
ただしSample C は飽和しているため、より正確に見積るために、サンプルを希釈して再度電気泳動を行う方が良いでしょう。
RNAの混入
過度のRNAの混入は、シーケンス反応を阻害する恐れがあります。アガロースゲル電気泳動の結果、RNAの混入が確認された場合は、RNase処理等でRNAを除去してください。

PCR産物
下記はPCR産物を各1uL電気泳動した結果です。
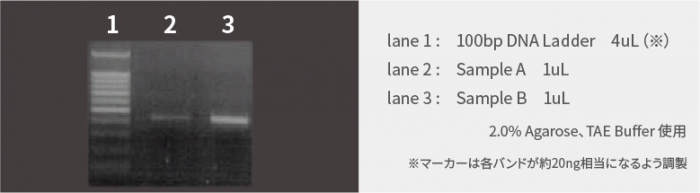
マーカーのバンドをもとに、各サンプル濃度を見積もると、以下の通りとなります。
| Sample A(lane 2) | 約15ng/uL |
| Sample B(lane 3) | 60ng/uL 以上 |
非特異的産物やプライマーの残存
バンドが複数本見られる場合や、プライマーの残存が見られる場合は、ゲルからの切り出し精製 または プライマーの除去を再度行ってください。PCR反応からの持ち込み成分は、サイクルシーケンスに影響を与える可能性があります。

シーケンスサンプルの調製方法
プレミックス
下表の量のDNAテンプレートと、プライマー(10pmol)をミックスし、滅菌水でトータル20uLに調製します。
| サンプルの種類 | サンプルサイズ | 推奨量 | ||||||
| プラスミド | – | 450 | – | 900 | ng | |||
| PCR産物 | 100 | – | 200 | bp | 3 | – | 10 | ng |
| 200 | – | 500 | bp | 10 | – | 30 | ng | |
| 500 | – | 1,000 | bp | 15 | – | 60 | ng | |
| 1,000 | – | 2,000 | bp | 30 | – | 115 | ng | |
| > | 2,000 | bp | 60 | – | 140 | ng | ||
200 – 500bp のPCR産物の場合
| DNAテンプレート(PCR産物) | 20ng |
| プライマー | 10pmol |
| 滅菌水 | up to 20uL |
| Total | 20uL |
プレミックスでは、お客様が調製したサンプルをそのまま一律量にてシーケンス解析に使用します。濃度が推奨範囲と異なる場合、良好な結果が得られない恐れがありますのでご注意ください。
ワンパス・フル
下記の濃度にサンプル、プライマーを調製のうえ、必要量以上を送付してください。
- サンプル送付時の蒸発等により、体積がロスする可能性があります。濃度が高い場合でも、送付量は必ず必要量以上でお願いいたします。
- 同一サンプルで複数の解析をご希望の場合は、解析数に応じた分量のサンプルを1本のチューブにまとめて送付してください。
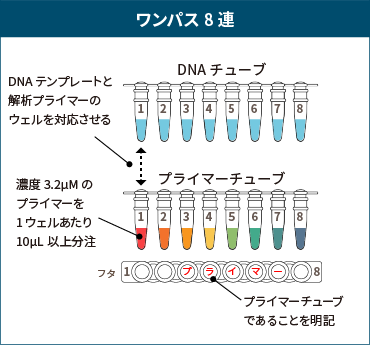
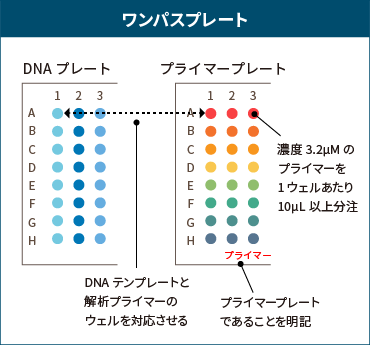
ワンパス8連、ワンパスプレートのプライマー使用数に関するご案内
- プライマーの使用は、原則として、8連チューブ1本 または 1プレート につき2種類まで とさせていただきます。
- 3種類以上のプライマーを使用される場合は、サンプルと同じように整列・分注した専用のプライマープレートのご準備をお願いしております。作成方法について詳しくは次項のプライマープレートの作成方法をご覧ください。
プライマープレートの作成方法
ワンパス8連 または ワンパスプレートで、3種類以上のプライマーを使用する場合、DNAテンプレートと対応するプライマープレートをご準備ください。
プライマープレート
- DNAサンプルとは別に、8連チューブまたはプレートをご用意いただき、DNAテンプレートに対応するようにプライマーを整列させてください。
- 濃度3.2μMのプライマーを、1ウェルあたり10μL以上分注してください。
- プライマープレート(チューブ)には、必ず「プライマー」と明記してください。